
Prix Nobel 2017 : rythme circadien et horloge biologique
Le prix Nobel 2017 de physiologie ou de médecine a été attribué à Jeffrey C. Hall, Michael Rosbash et Michael W. Young parce qu’ils ont pu regarder dans notre horloge biologique et élucider le fonctionnement interne du rythme circadien. Leurs découvertes expliquent comment les plantes, les animaux et les humains adaptent leur rythme biologique de manière à ce qu’il soit synchronisé avec les révolutions de la Terre qui nous aide à anticiper et à nous adapter au rythme régulier de la journée.
Découvertes primées autour de l’horloge biologique
En utilisant les mouches des fruits comme modèle d’organisme, les lauréats du prix Nobel de cette année ont isolé un gène qui contrôle le rythme biologique quotidien normal. Pour une protéine, ils ont montré que ce gène code qui s’accumule dans la cellule pendant la nuit, puis se dégrade pendant la journée. Par la suite, ils ont identifié des composants protéiques supplémentaires de cette machine, exposant le mécanisme régissant l’horloge autonome à l’intérieur de la cellule. Nous reconnaissons maintenant que les horloges biologiques fonctionnent selon les mêmes principes dans les cellules d’autres organismes multicellulaires, y compris les humains.
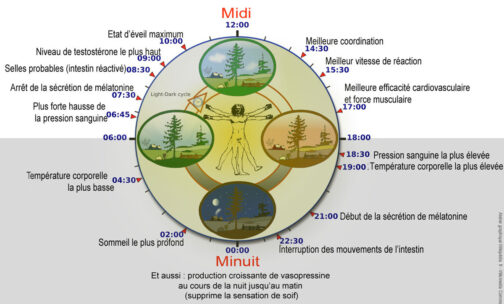
Avec une précision exquise, notre horloge intérieure adapte notre physiologie aux phases très différentes de la journée. L’horloge réglemente les fonctions critiques telles que :
- le comportement,
- les niveaux d’hormones,
- le sommeil,
- la température corporelle,
- le métabolisme.
Notre bien-être est affecté lorsqu’il existe un décalage temporel entre notre environnement externe et cette horloge biologique interne, par exemple lorsque nous traversons plusieurs fuseaux horaires et que nous expérimentons un « jet lag ». Il est également indiqué que le désalignement chronique entre notre style de vie et le rythme dicté par notre chronométreur interne est associé à un risque accru pour diverses maladies.
Plantes de Mimosa et horloge interne
La plupart des organismes vivants anticipent et s’adaptent aux changements quotidiens de l’environnement. Au cours du 18ème siècle, l’astronome français, Jean Jacques d’Ortous de Mairan, né à Béziers en 1743 et mort à Paris en 1671 a étudié les plantes de Mimosa. Il a constaté que les feuilles s’ouvraient vers le soleil pendant la journée et se fermaient au crépuscule. Il s’est demandé ce qu’il se passerait si la plante était placée dans l’obscurité constante. Il a constaté que, indépendamment de la lumière du jour, les feuilles continuaient à suivre leur oscillation quotidienne normale.
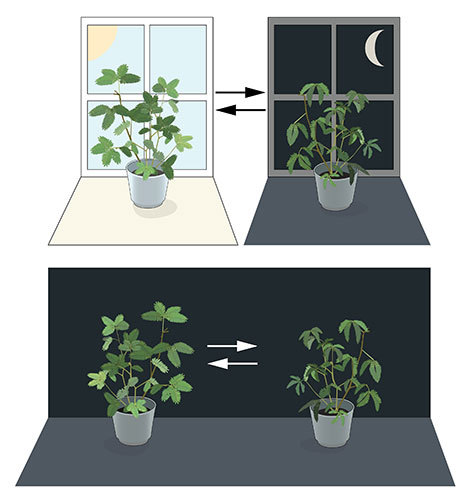
Les plantes semblaient avoir leur propre horloge biologique. D’autres chercheurs ont constaté que non seulement les plantes, mais aussi les animaux et les humains, ont une horloge biologique qui aide à préparer notre physiologie aux fluctuations de la journée. Cette adaptation régulière est appelée le rythme circadien, issu des mots latins « circa » signifiant « environ » et « diem » signifiant « un jour ». Mais la façon dont notre horloge biologique interne circadienne travaille restait un mystère.
Identification du gène horloge
Dans les années 1970, Seymour Benzer 1921-2007 et son élève Ronald Konopka 1947-2015 se sont demandé s’il serait possible d’identifier des gènes qui contrôlent le rythme circadien dans les mouches des fruits. Ils ont démontré que des mutations dans un gène inconnu perturbait l’horloge circadienne des mouches. Ils ont appelé ce gène Période. Mais comment ce gène pourrait-il influencer le rythme circadien ?
Les lauréats du prix Nobel 2017 étudiaient aussi les mouches des fruits. Ils visaient à découvrir comment l’horloge fonctionnait réellement. En 1984, Jeffrey Hall et Michael Rosbash, travaillant en étroite collaboration à Brandeis University à Boston, et Michael W. Young à l’Université Rockefeller à New York, ont réussi à isoler le gène Période. Jeffrey Hall et Michael Rosbash ont ensuite découvert que la PER, la protéine codée par Période, s’est accumulée pendant la nuit et a été dégradée pendant la journée. Ainsi, les niveaux de protéines de PER oscillent sur un cycle de 24 heures, en synchronisme avec le rythme circadien.
Mécanisme d’horlogerie autorégulateur
L’objectif clé suivant était de comprendre comment ces oscillations circadiennes pourraient être générées et soutenues. Jeffrey Hall et Michael Rosbash ont émis l’hypothèse que la protéine PER bloquait l’activité du gène Période. Par une boucle de rétroaction inhibitrice, ils ont raisonné que la protéine PER pourrait empêcher sa propre synthèse et ainsi réguler son propre niveau en continu dans un rythme cyclique.
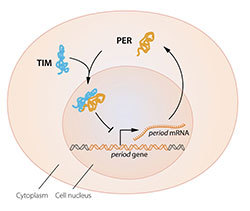
En 1994, Michael W. Young a découvert un deuxième gène d’horloge, intemporel, codant pour la protéine TIM requise pour un rythme circadien normal. Dans un travail élégant, il a montré que lorsque TIM lié à PER, les deux protéines ont pu entrer dans le noyau cellulaire. Ainsi, ils ont bloqué l’activité des gènes Période pour fermer la boucle de rétroaction inhibitrice. Il a aussi identifié un autre gène, double temps, codant pour la protéine DBT qui retarde l’accumulation de la protéine PER. Cela a permis de mieux comprendre comment une oscillation est ajustée pour correspondre plus étroitement à un cycle de 24 heures.

Notre horloge biologique humaine
L’horloge biologique est impliquée dans de nombreux aspects de notre physiologie complexe. Nous savons maintenant que tous les organismes multicellulaires, y compris les humains, utilisent un mécanisme similaire pour contrôler les rythmes circadiens. Une grande partie de nos gènes est régulée par l’horloge biologique et, par conséquent, un rythme circadien soigneusement calibré adapte notre physiologie aux différentes phases du jour.
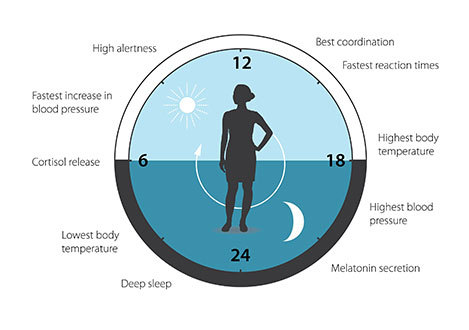
Depuis les découvertes des trois lauréats du prix Nobel 2017, la biologie circadienne s’est transformée en un domaine de recherche vaste et très dynamique, avec des implications pour notre santé et notre bien-être.
En France, plusieurs équipe travaillent sur ce thème dont le Professeur Claude Gronfier, chercheur Inserm et chronobiologiste, Institut Cellule Souche et Cerveau de Lyon. Avec le prix Nobel de Physique 2014 remis pour les inventeurs de la LED bleue, il semble que la lumière soit devenue très tendance après l’Année internationale de la Lumière 2015. Qu’en pensez-vous ?
Parcours des lauréats en bref
Jeffrey C. Hall

Né en 1945 à New York aux États-Unis, il a obtenu son doctorat en 1971 à l’Université de Washington à Seattle. Il était auparavant boursier postdoctoral à l’Institut de technologie de Californie à Pasadena de 1971 à 1973. Il a rejoint la faculté de l’Université Brandeis à Waltham en 1974. En 2002, il est devenu associé avec l’Université du Maine.
Michael Rosbash

Né en 1944 à Kansas City aux États-Unis, il a obtenu son doctorat en 1970 au Massachusetts Institute of Technology à Cambridge. Au cours des trois années suivantes, il était stagiaire postdoctoral à l’Université d’Édimbourg en Écosse. Depuis 1974, il a été professeur à l’Université Brandeis à Waltham aux États-Unis.
Michael W. Young

Né en 1949 à Miami, aux États-Unis, il a obtenu son doctorat à l’Université du Texas à Austin en 1975. Entre 1975 et 1977, il était stagiaire postdoctoral à l’Université de Stanford à Palo Alto. Depuis 1978, il a été professeur à l’Université Rockefeller de New York.
Principales publications des lauréats
- Zehring, W.A., Wheeler, D.A., Reddy, P., Konopka, R.J., Kyriacou, C.P., Rosbash, M., and Hall, J.C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369–376.
- Bargiello, T.A., Jackson, F.R., and Young, M.W. (1984). Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312, 752–754.
- Siwicki, K.K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J.C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141–150.
- Hardin, P.E., Hall, J.C., and Rosbash, M. (1990). Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343, 536–540.
- Liu, X., Zwiebel, L.J., Hinton, D., Benzer, S., Hall, J.C., and Rosbash, M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735–2744.
- Vosshall, L.B., Price, J.L., Sehgal, A., Saez, L., and Young, M.W. (1994). Block in nuclear localization of period protein by a second clock mutation, timeless. Science 263, 1606–1609.
- Price, J.L., Blau, J., Rothenfluh, A., Abodeely, M., Kloss, B., and Young, M.W. (1998). double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 94, 83–95.









Bonjour,
Merci à vous pour votre article.
Je souhaite quand même faire remarquer une petite erreur à corriger sans doute (sinon ce Monsieur est vraiment extraordinaire) :
« Jean Jacques d’Ortous de Mairan, né à Béziers en 1968 et mort à Paris en 1771 » (à l’âge de -197 ans 😉 )
@Samved En effet 🙂 Cette erreur est très répandue en ligne semble t’elle, y compris sur Wikipédia ce soir !
Rectification : Jean Jacques d’Ortous de Mairan est né à Béziers en 1678 et mort à Paris en 1771.
Pour en savoir plus, voici l’éloge de l’Académie des Sciences : https://www.academie-sciences.fr/pdf/eloges/mairan_p89_vol3569.pdf
@Société Française de Chronobiologie Merci pour la revue de presse et la mention de notre portail dans les Échos aux Prix Nobel 2017 !