Raies sombres, raies lumineuses : les spectres et la matière
Avec sa célèbre expérience démontrant la décomposition de la lumière blanche par un prisme en lumières élémentaires colorées, Newton a incontestablement établi les bases de la spectrophotométrie, c’est-à-dire la mesure et l’analyse des spectres lumineux. Pourtant, pendant près d’un siècle, aucune découverte d’importance ne sera faite dans ce domaine. À vrai dire, rien ne ressemble plus à un spectre continu qu’un autre spectre continu. C’est au contraire la mise en évidence de discontinuités dans les spectres – raies sombres ou lumineuses – qui va véritablement faire éclore cette discipline.

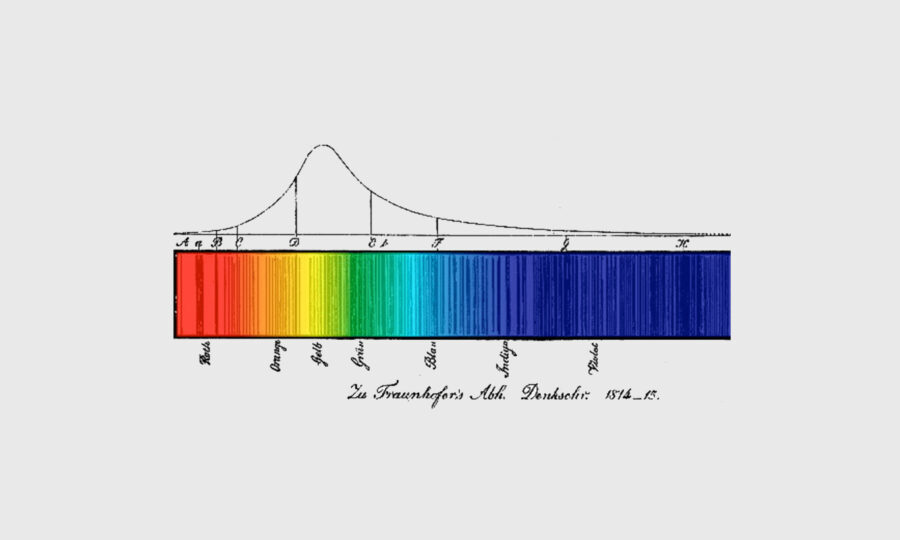
Raies sombres du spectre solaire
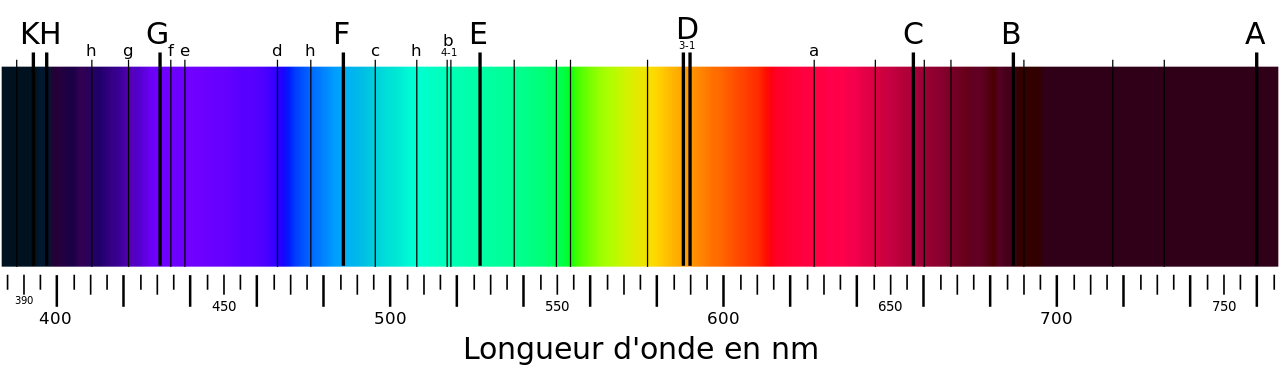
Il faut attendre pour cela le début du XIXe siècle. Grâce à la meilleure dispersion angulaire des prismes, Wollaston observe un phénomène étrange : quelques raies sombres dans le spectre solaire ! Fraunhofer va plus loin et développe un nouvel élément dispersif : un réseau formé de fils métalliques également espacés. Il répertorie un nombre important de raies sombres du spectre solaire et indexe alphabétiquement les plus importantes, une nomenclature encore d’usage aujourd’hui.
Dans les années 1860, la collaboration entre le physicien Kirchhoff et le chimiste Bunsen à l’université de Heidelberg permet de mieux interpréter ces raies sombres et d’établir les lois suivantes de la spectroscopie :
- un solide porté à incandescence produit un spectre continu ;
- un gaz chauffé produit un spectre de raies de différentes longueurs d’onde ;
- un solide porté à incandescence et entouré d’un gaz froid produit un spectre presque continu, présentant des raies sombres.
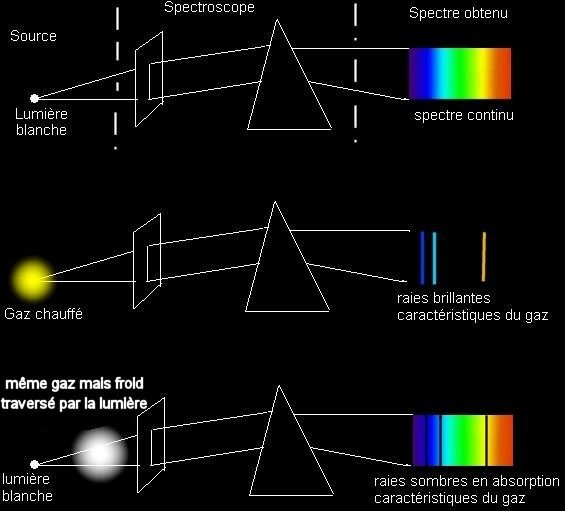
Les raies d’émission d’un gaz chauffé correspondent aux raies sombres du spectre lorsqu’une lumière blanche traverse ce même gaz. Ces raies constituent donc une signature des éléments chimiques présents dans le gaz. Pour les raies sombres du spectre solaire, ils indiquent la présence de certains atomes dans les couches supérieures du Soleil.
Comment produire et interpréter des raies lumineuses
Pour obtenir l’émission de raies lumineuses, Kirchhoff et Bunsen introduisent des sels métalliques dans la flamme incolore… d’un bec Bunsen. Ils obtiennent les mêmes spectres lorsque ces sels métalliques sont introduits dans un tube à décharge électrique (tube de Geissler). Ces résultats formidables permettent la découverte de nouveaux éléments : le césium et le rubidium. Viendront ensuite par d’autres savants : le thallium, l’indium, le gallium, le scandium et le germanium. Ces découvertes valident aussi la classification périodique des éléments proposée par Mendeleïev.
Pourtant, la compréhension des positions spectrales des raies lumineuses semble inaccessible. Les savants pensent dans un premier temps à des relations harmoniques mais ça ne colle pas. Ils s’intéressent particulièrement au spectre de l’hydrogène car c’est l’atome le plus simple. En analysant la série des quatre raies dans le visible, le mathématicien Balmer, passionné de numérologie, arrive à établir une formule permettant de relier de manière très satisfaisante les longueurs d’onde de ces raies. Mais l’approche est totalement empirique.

Les développements en spectroscopie se poursuivent et l’interprétation des résultats se complexifie un peu plus. Les spectres d’émission peuvent évoluer sous certaines conditions. Par exemple, les raies spectrales se dissocient sous l’effet d’un champ magnétique (effet Zeeman). Un spectre ne constitue donc pas une signature absolue d’un élément chimique.
L’atome de Bohr
En 1913, Niels Bohr a 27 ans et déjà une idée précise de la structure électronique d’un atome : un noyau chargé positivement autour duquel gravitent des électrons chargés négativement. Pour tenir compte de la théorie des quanta de Planck et Einstein, Bohr imagine que ces électrons ont la possibilité de changer d’orbites en émettant un quantum d’énergie, appelé photon. Mais il ne se préoccupe pas à déterminer les longueurs d’onde d’émission de l’atome car le problème lui semble trop complexe. Pourtant, en prenant connaissance de la formule de Balmer, tout devient clair ! En un mois, il établit un modèle d’atome d’hydrogène qui valide son approche d’orbites quantifiées et permet de prédire les raies spectrales d’émission. C’est un pas de géant dans la compréhension de la structure électronique de la matière. Le modèle va rapidement se perfectionner pour prendre en compte d’autres résultats de la spectrométrie comme l’effet Zeeman. « Electrons et photons », c’est le thème du 5ème congrès Solvay qui en 1927 réunit les principaux fondateurs de la physique quantique.

Raies lumineuses en éclairage
Produire des raies lumineuses n’a pas été qu’un enjeu scientifique. En alternative aux lampes à incandescence et avant l’avènement des LED, les lampes à décharge ont en effet largement contribué à l’éclairage artificiel du XXe siècle. Des spectres de raies sont obtenus à basse pression. Ils sont intéressants pour la lumière colorée comme les tubes néon inventés en 1910 par Georges Claude pour la publicité lumineuse. Les nombreuses raies du néon dans les grandes longueurs d’onde du visible lui confèrent son aspect rouge caractéristique.
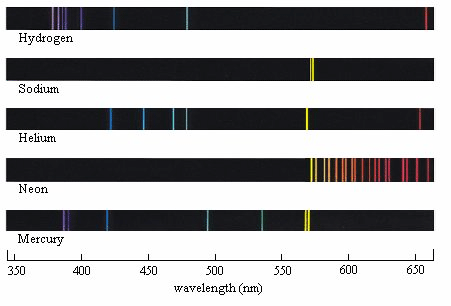
En revanche, l’émission de raies spectrales n’est pas la bonne solution pour l’obtention d’une lumière blanche avec un rendu des couleurs acceptable. Dans les tubes fluorescents, le mercure, utilisé également à basse pression, présente quelques raies dans le visible. Mais sa raie principale est à 254 nm dans l’UV, et est convertie par les poudres fluorescentes en un rayonnement visible, spectralement beaucoup plus riche.
L’autre solution pour obtenir un spectre « plus continu » consiste à opérer à haute pression. C’est le cas des lampes à décharge pour l’éclairage public. La vidéo suivante présente l’évolution du spectre d’émission à l’allumage d’une lampe sodium haute pression. Dans un premier temps, la décharge s’amorce dans du sodium à basse pression dont l’émission est pratiquement monochromatique à 589 nm correspondant au jaune orangé. La pression augmentant, le spectre devient beaucoup plus riche et se stabilise après 2 min. On notera le phénomène étonnant d’auto-absorption de la raie à 589 nm.
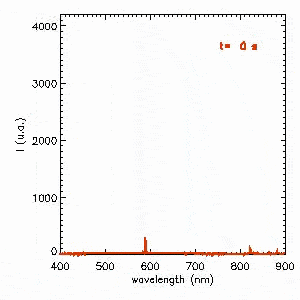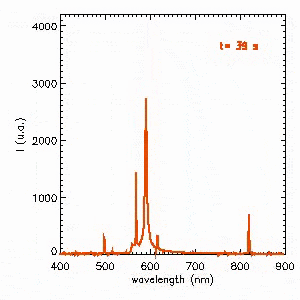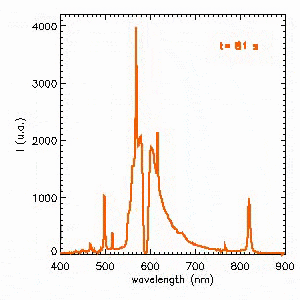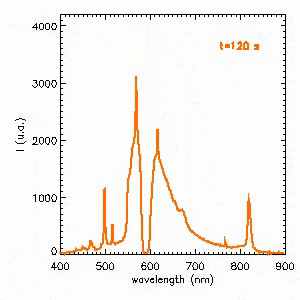

Approfondir le sujet
- La couleur fascinante des lampes LED à travers les spectres lumineux
- Spectre lumineux et continu du corps noir
- Spectre visible, colorimétrie et vision
- Domaine visible des couleurs de la lumière
Dessin en tête de l’article : raies sombres du spectre solaire, de Joseph van Fraunhofer, 1815-15 – extrait de Robert Hunt, History of Spectroscopy, an essay, 2011 © Joseph van Fraunhofer
Équipe du projet
Livres
Lumière et luminescence, ces phénomènes lumineux qui nous entourent
 |
Un livre tous public et pédagogique sur la lumière en science chimie, biologie et physique. L'idéal pour l'Année internationale de la Lumière 2015. |
Traité d'éclairage, de William Sanial - 2e Éd.
 |
Lumière, éclairage et couleur. Ce Traité d'éclairage, de William Sanial, est le livre de référence de l'ingénieur éclairagiste pour tous. |
Lumières du futur, de Libero Zuppiroli et Daniel Schlaepfer
 |
Sur un ton direct, Lumières du futur, de Libero Zuppiroli et Daniel Schlaepfer, le livre présente une approche croisée scientifique et artistique. |






